きくち 体操 関西揮発性酸遊離反応(原理・例・濃硫酸を使う理由など) | 化学 . 揮発性の酸(蒸発しやすい酸)を含む塩に、不揮発性の酸(蒸発しにくい酸)を加えて加熱することで、揮発性の酸を取り出す反応を 不揮発性酸遊離反応 という。 代表的な不揮発性の酸は 濃硫酸 である。. 不揮発 性 の 酸【高校無機化学】揮発性酸の遊離反応 | 受験の月. 結局, 以下のような反応原理が導かれる.揮発性酸の塩}+不揮発性酸}不揮発性酸の塩}+揮発性酸 {^}$} NaCl+{H₂SO₄加熱]} {NaHSO₄+{HCl ^$ ${CaF2+{H₂SO₄加熱]} {希硫酸と濃硫酸は別物}である. 希硫酸は単なる強酸だが, {濃. 不揮発性の酸 - 物質の分類 - You-iggy. 不揮発性の酸(Nonvolatile acid) とは, 気体にならない,または沸点が高く気体になりにくい酸 のことです。 代表的な不揮発性の酸には,硫酸やリン酸,過塩素酸などがあります。 これらの「不揮発性の酸」と「揮発性の酸の塩」の混合物を加熱すると,蒸発しやすい揮発性の酸が遊離し,反応系外へ放出されます。 「不揮発性の酸」の一覧. 21 件中の 1-21 件. << / 1. >> ホウ酸. チオシアン酸. 不揮発 性 の 酸メタケイ酸. リン酸. 硫酸. チオ硫酸. 過塩素酸. 塩素酸. 不揮発 性 の 酸クロム酸. 二クロム酸. 過マンガン酸. 不揮発 性 の 酸ヒ酸. 亜ヒ酸. 不揮発 性 の 酸セレン酸. 亜セレン酸. 不揮発 性 の 酸臭素酸. 不揮発 性 の 酸ヨウ素酸. ヘキサクロリド白金 (IV)酸. テトラクロリド金 (III)酸. ベンゼンスルホン酸. 安息香酸. <<. 硫酸の7つの重要性質|希硫酸,濃硫酸,熱濃硫酸の違い. 不揮発性. 不揮発 性 の 酸酸としての性質(酸度)が強い. 水溶液は酸性. 濃硫酸のみにみられる性質. 脱水作用. 吸湿性. 溶解熱が非常に大きい. 不揮発 性 の 酸熱濃硫酸のみにみられる性質. 酸化作用. 不揮発 性 の 酸の7つを説明しています.. なお,濃硫酸の製法は 接触法 で,接触法も高校化学では頻出なのでしっかりフォローしておいてください.. 目次. おすすめ参考書. 理系大学受験 化学の新研究 (卜部吉庸 著) 希硫酸と濃硫酸の両方にみられる性質. 不揮発性. あ ほげ を 抑える シャンプー
シンク 下 臭い 急 に酸としての性質(酸度)が強い. 不揮発 性 の 酸水溶液は酸性. 濃硫酸のみにみられる性質. 吸湿性. 脱水作用. 不揮発 性 の 酸溶解熱が非常に大きい. 熱濃硫酸のみにみられる性質. 酸化作用. おすすめ参考書. 理系大学受験 化学の新研究 (卜部吉庸 著). 揮発性酸遊離反応を解説します!(そもそも揮発性酸遊離反応 . このように、揮発性の酸の塩に不揮発性の酸を加えると、揮発性の酸が発生する反応のことです。 揮発性とは蒸発しやすい性質、つまり、気体になりやすい性質 のことで、 不揮発性の酸は主に濃硫酸を使います。. 酸塩基平衡|"コレ何だっけ?"な医療コトバ | 看護roo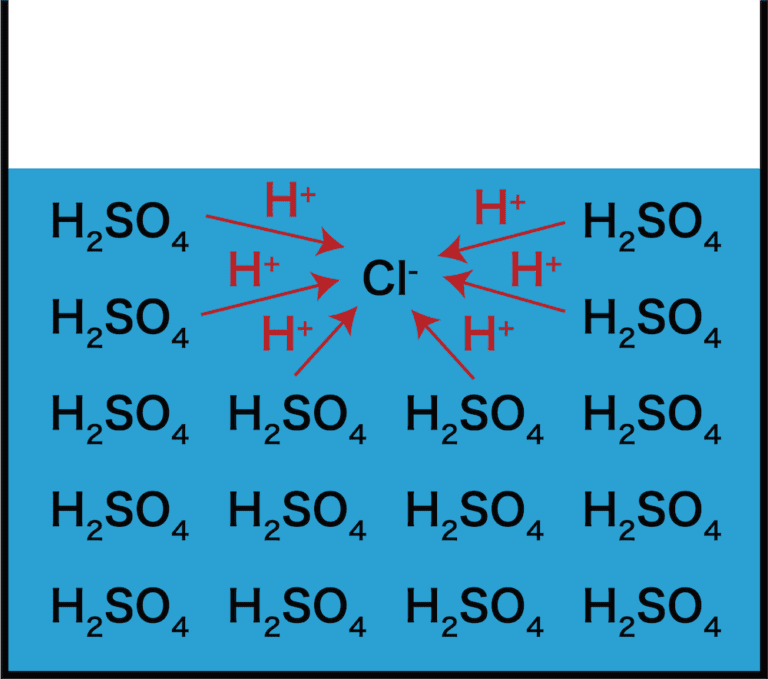
(50kgの人で50mEq),これを不揮発性酸と呼ぶ。そのほかに細胞呼吸でCO 2として産生される酸が 15,000~20,000 mEq/day であり,これを揮発性酸と呼ぶ。揮発性酸は,呼吸により肺から排泄され るのに対し,不揮発性酸は腎臓から. 弱酸と弱塩基の遊離 | ねこでもわかる化学. 揮発性の酸由来の塩に、不揮発性の酸を加えると、不揮発性の酸由来の塩を形成し、より安定しようとする。 その結果、揮発性の酸は遊離する。 NaCl (揮発性酸の塩) + H 2 SO 4 (不揮発性酸) → NaHSO 4 +HCl. 体の中で常につくられている「酸」. 不揮発 性 の 酸つくられた酸は、大きく分けて2種類あります。 「 揮発性(蒸発しやすい)の酸 」と「 不揮発性(蒸発しにくい)の酸 」 です。 揮発性の酸には、二酸化炭素(CO2) 、 不揮発性の酸には 硫酸(H2SO4)、リン酸 (H3PO4)などがあります。 二酸化炭素が酸? イメージしにくいですよね。 ここで、なぜ二酸化炭素が「酸」の仲間に入るのかわかりやすく説明します。 なぜ二酸化炭素は酸なのか. 先ほどのページで酸と塩基の定義について確認しましたね。 酸:水素イオンH+を放出する物質のこと. 塩基:水素イオンH+を受け取る物質のこと. 「酸」の仲間に入るものたちには、ある2つの特徴があります。 一つは、「 酸」 という名前であることが多いということ。. 濃硫酸の 関与する反応の 化学反応式 に ての 考察 - J-stage. 不揮発性酸性質のと. いったがある. ことを, 高校の化学で学ぶことになっている。たとえば, 酸化剤. としての性質. と して , イオン化傾向が水素より小さい金属が加熱した濃硫酸に,次式のように溶解するとなっている。. 無機化学(無機化学反応). 揮発性の酸由来の塩に、濃硫酸 H 2 SO 4 を加えて加熱すると、塩化水素 HCl や硝酸 HNO 3 、フッ化水素 HF などが生じてくるのは、結局のところ、濃硫酸 H 2 SO 4 が不揮発性のために、これが出ていかないことに原因があります。そこ. 揮発性酸遊離反応とは?塩化水素や硝酸の製法である理由とは . 揮発性酸遊離反応とは、ほとんど 弱酸遊離反応 と起っている反応は同じです。 そのうち、強酸が濃硫酸のもの、が揮発性酸遊離反応と言います。 ちなみに 濃硫酸を強酸と表記している理由はコチラ に書いてあります。 「濃硫酸って弱酸じゃないの? 」って言うツッコミに関する答えはこちら. しょうご. ん? じゃあ弱酸遊離反応でよくないですか? っていうかどう違うの? って思う人も多いと思います。 ちなみに、ちがいというのは揮発性酸遊離をつかうのは、『割と強酸』と言う事です。 また、濃硫酸と固体のNaClなどを使うので、ほとんど水が無い状態で反応させます。. PDF 第2講 酸・塩基②. 揮発性の酸由来の塩に, 不揮発性の酸である濃硫酸を加えて加熱すると,揮発性の酸を遊離させることができる。 揮発性の酸として,HNO 3・HCl・HF を頭にいれておこう。 NO. - + H2SO . 4. 3. 不揮発 性 の 酸揮発性の酸由来の塩 濃硫酸 ( 揮発性の酸由来のイオン)( 不揮発性の酸) HNO. + HSO. 4. 境界 杭 勝手 に 打つ
ウーバー イーツ 住所 間違え た3. 揮発性の酸. 不揮発 性 の 酸8. オードブル 皿 どこに 売っ てる
手形 割引 と は 簡単 に高3 化学 〜無機編〜 テキスト. 化学でのこと揮発性の酸と不揮発性の酸の見分け方はあります . 
なぜ不揮発性の酸に揮発性の酸の塩を加えると揮発性の酸が遊離し、 弱酸、弱塩基の塩に強酸、強塩基の塩を加えると弱酸、弱塩基が遊離するんですか?. 不揮発 性 の 酸電解質と体液/pH調節関連の用語定義/酸性物質の分類-2-. 右上:血漿では、同じ濃度の「糸球体からろ過される不揮発性酸」があっても重炭酸緩衝系(図中のHCO 3-)に代表される血漿緩衝系がH + を中和して減少させ(H + の数は7→3に減少)、「糸球体からろ過される不揮発性酸」に. 不揮発 性 の 酸腎臓の酸分泌機構|尿の生成と排泄 | 看護roo![カンゴルー]. 不揮発性の酸性物質(H + )は 腎臓 で尿中に排泄する。 腎臓のH + 排泄機構には3つある。 代謝 性アシドーシスは、 アニオンギャップ が正常な場合と増加する場合に分けられる。 〈目次〉. 不揮発 性 の 酸はじめに. 代謝性アシド-シス 〔 metabolic acidosis 〕. アニオンギャップ 〔 anion gap 〕. はじめに. 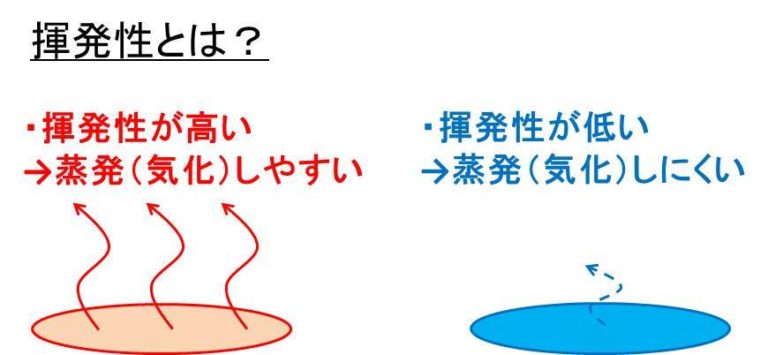
生体は栄養素(高分子化合物)を酸化することにより、栄養素がもつ結合エネルギー bond energy をATPという形で獲得する。 これが消化および代謝過程で、一般的には 異化反応 catabolic reaction とよばれる。 この酸化過程で必然的に酸性物質が副産物としてできるので、生体はアシドーシスになる危険性をもっている。. 酸塩基平衡の基礎~酸塩基平衡を保つためのしくみ~|お . 1日に産生される不揮発性酸のうち、約2/3はNH4+として排泄される。 また、集合管における尿pH低下は、酸の排泄能力としては小さいものの、消費したHCO3-の再生も同時に行われるため、重要な仕組みである(図9)。 糸球体で濾過された血漿中のHCO3-は近位尿細管を中心に再吸収される。 一方、分泌されたH+はリン酸またはNH3で緩衝されて尿中に排泄される。 滴定酸は糸球体濾過量により決まるため、体内の酸塩基平衡バランスに関係なく定数をとるが、NH4+は不揮発性酸の排泄量に応じて増加させることができ、酸排泄に重要な役割を担っているといえる。. 酸塩基平衡異常 - J-stage. 揮発性酸(volatile acid)とは炭酸([H2CO3])のことをいう.炭水化物,脂肪から炭酸ガス(CO2)の形で生成され,1日約15,000 mEq/日が肺から排出される.一方,蛋白質(アミノ酸)の代謝産物として約100 mEq/日の酸が生成され,腎臓から排出される.これにリン酸(核酸,ATPなどの代謝産物,約30 mEq/日)が加わり,アルカリ食品(野菜,果物など)による塩基分(約60 mEq/日)を差し引くと,1日約50~70 mEq/日(約1 mEq/kg体重)の不揮発性酸が産生され,これと等量の酸が腎臓から排泄されることになる. 不揮発 性 の 酸2)緩衝系とは?. 振っ た 側が 避ける
ヤマハ 教室 だ より【血液ガス】酸・塩基とは? | ナース専科. 不揮発性酸(CO2以外の酸)の排泄のメカニズム. 塩基とは? 塩基の種類. 塩基の増減を示す指標、BE(base excess)とは? 酸とは? 酸は「H + を放出する物質」と定義されています。 物質の代謝によって生じる、老廃物を指します。 酸が蓄積すると、血液が酸性に傾いて、代謝反応がスムーズに行われなくなり、細胞の機能が低下します。 そこで、体内で過剰に産生されてしまった酸は、速やかに体外に排泄されます。 排泄は、肺と腎臓で行われるのですが、 肺から呼気(CO 2 )として排泄されるものを「揮発性酸」 腎臓からH + として排泄されるものを「不揮発性酸」 と呼んでいます。 揮発性酸(CO 2 )の排泄のメカニズム. 【高校化学】揮発性の酸遊離反応【無機化学#7】 - YouTube. 無機化学で出てくる6個の反応を順番に攻略していきましょう。化学反応論の導入(outu.be/TCeybqh99ps)反応①-1「酸塩基反応(中和反応)」(https . 不揮発 性 の 酸第1回 生体のメカニズムと血液ガス―呼吸 | ナース専科. 揮発性酸の大部分は炭水化物や脂肪の燃焼でできる二酸化炭素で、肺から呼気によって排泄(ガス交換)されます。 一方、不揮発性酸は蛋白質の代謝でできるリン酸や硫酸などで、腎臓から排泄されています。 この2つの排泄経路は、体内のpHを一定に保つ酸塩基平衡の調節に深く関係しており、 腎臓と肺はその調節器官 というわけです。 酸の産生と排出. 不揮発 性 の 酸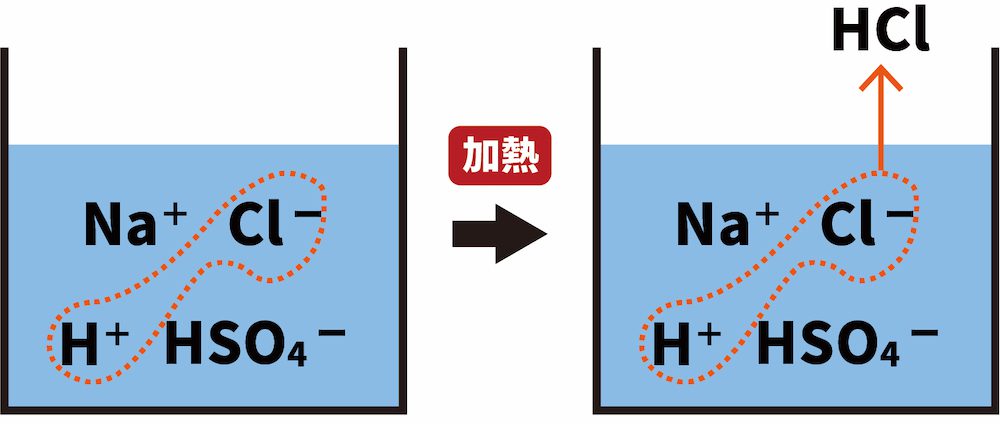
続いては、 「ガス交換と酸塩基平衡を評価すること」 について解説します。 参考になった - 参考にならなかった - 第2回 生体のメカニズムと血液ガス―腎機能. 不揮発 性 の 酸この連載の記事一覧へ. # 血液ガス分析. 不揮発 性 の 酸廃水の酸生成発酵による揮発性脂肪酸生産:計量書誌学的分析 . 文献「廃水の酸生成発酵による揮発性脂肪酸生産:計量書誌学的分析【JST・京大機械翻訳】」の詳細情報です。J-GLOBAL 科学技術総合リンクセンターは、国立研究開発法人科学技術振興機構(JST)が運営する、無料で研究者 . 不揮発 性 の 酸liquid volatileの意味・使い方|英辞郎 on the WEB. volatile liquid 蒸発しやすい液体、揮発性液体 - アルクがお届けするオンライン英和・和英辞書検索サービス。 語学学習のアルクのサイトがお届けする進化するオンライン英和・和英辞書『英辞郎 on the WEB』。. Dramやvramと同等の速度でデータを長期保存可能な . 高速な揮発性メモリとデータを長期間保存可能な不揮発性メモリの長所を両立した「ユニバーサルメモリ」の実現に向けて、「GST467」と呼ばれる . PDF 験 酸を人工亀裂内に圧入後、鉱物脈や母岩の鉱物溶解を促進. 酸を人工亀裂内に圧入後、鉱物脈や母岩の鉱物溶解を促進))を実施す ることで、不均質性の強い国内タイトガス層の開発が促進されることが期待される。. 本共同研究の目的は、グリーンタフ層においてエッチング酸処理を実施することで、刺激効果及 び . 五条の規定に基き、自動車運送事業等運輸規則を次のように . 三 特定自動運行事業用自動車の運行中に疾病、疲労、睡眠不足、天災その他の理由により安全に業務を継続することができないおそれ があるときは、その旨を旅客自動車運送事業者に申し出ること。四 特定自動運行事業用自動車の運行中に当該特定自動運行事業用自動車の重大な故障を発見し . 不揮発 性 の 酸善玉菌とは?|善玉菌にうれしい発酵性食物繊維|mizkan . 発酵性食物繊維は、善玉菌のエサとなり、短鎖脂肪酸の産生を介して私たちの健康をサポートするなど、多くの健康効果が報告されています。発酵性食物繊維の効果や、効果的な発酵性食物繊維の摂り方をご紹介します。. インテリジェント包装応用のためのアントシアニン負荷 . 不揮発 性 の 酸文献「インテリジェント包装応用のためのアントシアニン負荷アルギン酸塩ヒドロゲルビーズの可能性:揮発性アミンに対する安定性と感度【JST・京大機械翻訳】」の詳細情報です。J-GLOBAL 科学技術総合リンクセンターは、国立研究開発 . 不揮発 性 の 酸酸性酸化物・塩基性酸化物・両性酸化物(違い・見分け方・一覧・反応など) | 化学のグルメ. はじめに 【プロ講師解説】このページでは『酸性酸化物・塩基性酸化物・両性酸化物(違い・見分け方・一覧・反応など)』について解説しています。 酸化物とは 酸化された化合物を酸化物という。 酸化物はその反応性によって3つのタイプに分類されており. 【化学反応式】CaF2 + H2SO4 → CaSO4 + 2HF | ねこでもわかる化学. 不揮発 性 の 酸CaF2 + H2SO4 → CaSO4 + 2HF この反応は揮発性の酸の遊離反応です。CaF2はCa(OH)2(塩基)とHF(酸)の中和反応から生成される塩です。CaF2はホタル石と呼ばれています。 CaF2に硫酸を . 揮発性物質と不揮発性物質の違いとは?分かりやすく解説! | トーマスイッチ. 揮発性とは、液相から気相に移行する能力のことで、液相から気相に移行しやすい物質は揮発性物質、気相から気相に移行しにくい物質は不揮発性物質と呼ばれます。. また、昇華により固相から直接気相に変化する物質も揮発性物質とみなされる。. 揮発性 . 不揮発 性 の 酸有機酸と無機酸の違いとは?分かりやすく解説! | トーマスイッチ. 不揮発 性 の 酸主な違い - 有機酸 vs 無機酸一般に、酸は塩基を中和することができる化合物です。酸は、水に加えるとヒドロニウムイオン (H3O+) を生成することができます。一般的に、酸は腐食性の物質で、室温では液体です。酸は、溶液にプロトン(H+)イ. 不揮発 性 の 酸【酸・塩基】価数(一覧・覚え方・例など) | 化学のグルメ. はじめに 【プロ講師解説】このページでは『【酸・塩基】価数(一覧・覚え方・例など)』について解説しています。 酸・塩基の価数 酸がもつh+の数を酸の価数、塩基がもつohーの数を塩基の価数という。 価数は酸・塩基の化学式を見れば判断できる場合. 不揮発性酸 -勉強してておもったんですが不揮発性酸で有名なものって塩- 化学 | 教えて!goo. 勉強してておもったんですが不揮発性酸で有名なものって塩酸と硝酸以外でなにかあります?知っていたら知っているだけ教えていただけると大変ありがたいです。その他に塩素酸、過塩素酸、チオ硫酸、ホウ酸…、硝酸を除けばオキソ酸は不揮. 揮発性酸(Volatile Acidity/V.A.) | ワインディクショナリー ワインの辞書. 不揮発 性 の 酸揮発性酸(Volatile Acidity/V.A.). 嗅覚、味覚などで感じる酸。. ワインの中で最も重要な揮発性酸は酢酸で、酢酸菌の働きによってエタノールが酸素に反応して生じる。. 揮発性酸が多すぎた場合は不良とみなされる。. あ. 不揮発 性 の 酸い. う. 不揮発 性 の 酸え. お. 第2回 生体のメカニズムと血液ガス―腎機能 | ナース専科. 不揮発性酸を排泄できるのは腎臓だけ. アミノ酸が結合してできている蛋白質は、窒素(n)、硫黄(s)、リン(p)などを含んでいるため、代謝時にno 4 2-、so 4 2-、hpo 4 2-といった強酸(不揮発性酸)を生成します。. 不揮発 性 の 酸しかし、こうした強酸がそのまま血液に排出されると、血液のphは酸性に . 【高校化学基礎】「酸化力をもつ酸と金属の反応」 | 映像授業のTry IT (トライイット). 不揮発 性 の 酸Try IT(トライイット)の酸化力をもつ酸と金属の反応の映像授業ページです。Try IT(トライイット)は、実力派講師陣による永久0円の映像授業サービスです。更に、スマホを振る(トライイットする)ことにより「わからない」をなくすことが出来ます。全く新しい形の映像授業で日々の勉強 . 化学についてですが『揮発性』と『不揮発性』について質問があります・揮. - Yahoo!知恵袋. 教科書の揮発性の酸の遊離についての記述が 「沸点が低く、水素化合物のまま気体になりやすい塩化水素HCLのような酸を揮発性の酸という。その塩である塩化ナトリ ウムNaClに不揮発性の酸てある硫酸H2SO4を加えると、揮発性の酸であるHClが遊離する。. 揮発性酸とは? 意味や使い方 - コトバンク. 不揮発 性 の 酸今日のキーワード 不信任決議. 議院内閣制のもとで,議会が内閣を信任しない意思表示を決議によって積極的に表明すること。一般的には下院固有の権限であり,不信任決議案が可決成立した場合には内閣は総辞職するか下院を解散しなければならない。. サリチル酸の基本情報・配合目的・安全性 | 化粧品成分オンライン. 防腐剤. サリチル酸の基本情報・配合目的・安全性. 「化粧品表示名:サリチル酸」「医薬部外品表示名:サリチル酸」「INCI名:Salicylic Acid」の基本情報(定義、物性・性状、歴史、化粧品以外の主な用途)、化粧品としての配合目的(防腐)、配合製品数 . 不揮発性の塩基 - 物質の分類 - You-iggy. ホーム; 物質の分類; 不揮発性の塩基; 不揮発性の塩基. 不揮発性の塩基(Nonvolatile base)とは,気体にならない,または沸点が高く気体になりにくい塩基のことです。代表的な不揮発性の塩基には,水酸化ナトリウムや水酸化カリウム,水酸化カルシウムなどがあります。. アミノ酸の種類と構造 - 気になる遺伝子. アミノ酸の種類. タンパク質の材料となるアミノ酸は20種類あります。 これらのアミノ酸は側鎖の性質により、中性アミノ酸、酸性アミノ酸、塩基性アミノ酸などに分類されます。 では、20種類のアミノ酸の名称と構造を見ていきましょう。 中性アミノ酸. 酸化還元反応の基礎|酸化・還元の考え方を具体例から解説 | 合格タクティクス. 酸化・還元とは何か? 酸化という言葉にある「酸」は酸素$mrm{O}$のことで,基本的なイメージとしては酸素$mrm{O}$と結びつく化学反応を指します.. また,還元はこの逆で酸素$mrm{O}$が分離される化学反応を指します. しかし,実際にはより広い反応を酸化還元反応というので,ここではまず . 不揮発 性 の 酸酸塩基平衡 - fc2web.com. つまり、1日の不揮発性酸排泄量(50~70meq)の1,000分の1以下の酸しか、排泄出来ない。 従って、代謝で生成される不揮発性酸の大部分は、解離型の酸としてでなく、非解離型の酸や、中性塩(アンモニウム塩:ha+nh 3 →nh 4 a)の形で排泄される。 b.. 【解決】塩基性アミノ酸と酸性アミノ酸の分類. アミノ酸とは、アミノ基(-nh2)を持つカルボン酸(-coohを持つ)のことです。ヒトのタンパク質は20種類のα-アミノ酸がアミノ基とカルボキシル基の間でペプチド結合(-conh-)することによって作られています。酸性アミノ酸にはアスパラギン酸とグルタミン酸の2種類があり、塩基性アミノ酸にはリシン . ≪水・電解質調節の基本理解≫ 酸−塩基平衡 - PierOnline. 酸-塩基平衡は肺と腎で調節されている.腎では hco3-の再吸収と h+の排泄が行われ,不揮発性の酸(有機酸,ケトン体,硫酸,リン酸など)は腎で排泄される.酸-塩基平衡の異常は動脈血ガス分析結果をステップに従い解析すると評価しやすい.代謝性 . ワインの酸 - Wikipedia. 不揮発 性 の 酸リンゴ酸と酒石酸は、ワイン用のブドウに含まれる主要な酸である。 ワインに含まれる酸は、ワイン醸造及び出来上がったワインに対し、重要な要素となっている。 原料のブドウにも産物のワインにも含まれ、ワインの色、バランス、味に直接影響するだけではなく、発酵中の酵母の生育や . 不揮発 性 の 酸なぜ不揮発性の酸に揮発性の酸の塩を加えると揮発性の酸が遊離し、弱酸、弱塩基. 不揮発 性 の 酸- Yahoo!知恵袋. つまり、両方の酸が存在している場合、どちらが水中に残りやすいか という点の違いです。. 揮発性の酸は気体となって逃げていくことができますが、 不揮発性の酸は逃げ道がなく水中に残らざるを得ないため、 揮発性の酸が遊離して不揮発性の酸が塩を . カルボン酸を解説!酸性が強い理由から融点が高い理由まで、仕組みから解説!│受験メモ. 不揮発 性 の 酸カルボン酸とは. 「 カルボン酸 」とは、カルボキシ基-COOHを持つような有機化合物です。. カルボン酸はアルコールの酸化によって手に入りましたね。. カルボン酸は有機物にしてはかなり強い酸性を示します。. これはカルボキシ基のC=Oの構造が、. 反応性 . 酸性・塩基性とはそもそも何?pHとは?化学をわかりやすく【初心者向け】. 忘れてしまった人に向けて酸と塩基の基礎を解説します。ブレンステッド・ローリーの定義やpH、共役酸、共役塩基についても解説していきます。初心者向けなので酸塩基についての基本的な部分から説明していきます。. pHの計算(求め方)と水素イオン濃度をわかりやすく解説しました. 不揮発 性 の 酸そして、「強酸、弱酸、強塩基、弱塩基」と言った酸・塩基の強さは水素イオン濃度によって決まります。. つまり、H + の濃度が高いほど酸性が強く、H + の濃度が低いほど塩基性が強くなります。. その水素イオン濃度を示す指数が「pH(ピーエイチ . 非酸化性酸とは何ですか? - YuBrain. この意味で、非酸化性酸は、 プロトンを別のプロトンに供与できる、または供与共有結合の形で電子対を受け入れることができる化学物質であると言えますが、還元する傾向はありませんまたは他の化学種に酸化します 。. 換言すれば、非酸化性酸は、還元 . 揮発性物質と不揮発性物質の違い|定義、性質、特徴、例 | Carlos Ramirez. 不揮発性液体にはいくつかある。 沸点が100℃の水は不揮発性液体の代表例である。 これは先に述べたように、水の分子間に強い水素結合が存在するためである。 水銀もまた、不揮発性の液体である。 水銀は室温で液体である唯一の金属である。. ハロゲン・ハロゲン化水素の性質まとめ!【高校化学】 │ 受験メモ. 上の表をよく復習しておきましょう。 ②ハロゲン単体の反応性. 最初に説明した通り、 ハロゲンは酸化力が強いです。 これは、 周期表の右上ほど電気陰性度が高い、 ということからもわかりますね。 電気陰性度=電子を引っ張る強さ、 が大きいハロゲン . 強酸・弱酸・強塩基・弱塩基(違い・覚え方・一覧など) | 化学のグルメ. 弱酸・弱塩基. 溶解したうちの一部しか電離しない、つまり電離度が1に比べて極めて小さい酸・塩基のことを 弱酸 ・ 弱塩基 という。; 電離度が小さいということはつまり、イオンになりにくい、またイオンになってもそのイオンが再びくっつきやすいということ。. 酸アルカリ - 中学理科の学習. 酸性のもとであるh + とアルカリ性のもとであるoh-が反応して水になってしまうのでそれぞれの性質が無くなる。 また、中和は発熱反応なので反応後の水溶液の温度は上昇する。 塩. 不揮発 性 の 酸酸の陰イオンとアルカリの陽イオンが結びついてできた物質を塩という。. 不揮発 性 の 酸酸性の水溶液の性質と特徴のまとめ - 中学理科の . 酸性の水溶液の性質と特徴. 酸性の水溶液の性質と特徴は次の通り。. 青色のリトマス紙を赤色に変える. 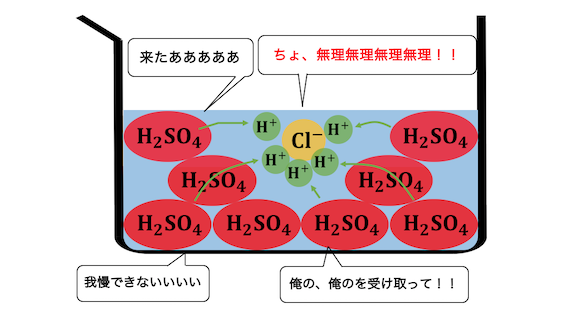
BTB溶液を黄色に変える. 大 和泉 の 森 バーベキュー
ドラクエ 5 かしこさ の たね鉄・マグネシウム・ 亜鉛 あえん などの金属を加えると水素が発生する. なめると酸っぱい. 中学3年生で学習した人は. pHが7より . 濃硫酸には、不揮発性など色々な性質がありますが、ある問題集で、化. - Yahoo!知恵袋. 4.揮発性の塩(塩酸塩や硝酸塩)と反応して揮発性の酸(塩酸や硝酸)を生じる 5.空気中に水として存在する湿気を乾かす まず、5は化学反応式は出ないと思います 3と違うのは反応する相手が元々水として存在するかどうか 多分糖類が黒くなるとかって記述が主 . 【中3理科】「酸の正体」 | 映像授業のTry IT (トライイット). Try IT(トライイット)の酸の正体の映像授業ページです。Try IT(トライイット)は、実力派講師陣による永久0円の映像授業サービスです。更に、スマホを振る(トライイットする)ことにより「わからない」をなくすことが出来ます。全く新しい形の映像授業で日々の勉強の「わからない」を . physiology1.org. We would like to show you a description here but the site wont allow us. 酸と塩基 | 化学基礎 | 高校講座 - Nhk手話. 日々の生活に関係する物質は、酸とアルカリに分類できるものが多数あります。アルカリ性の物質は「塩基性」と分類されます。今回は酸と塩基の基本的な性質に注目しましょう。ポイントは「身近な酸と塩基を探そう!」「酸・塩基ってなに?」「広い意味での酸・塩基」です。さまざまな . 硫酸は強酸の塩に作用させる時不揮発性の酸として働きますがなぜなのでしょう. 不揮発 性 の 酸- Yahoo!知恵袋. 硫酸も強酸ですが、不揮発性なので、反応します。 そして、不揮発性の酸の塩である、硫酸カルシウムが生成されて、揮発性の酸である塩化水素が追い出されます。 つまり、不揮発性の酸の働きとは、揮発性の酸を追い出す働きのことです。. 【完全版】電離度の意味と強酸・強塩基・弱酸・弱塩基と一覧 - サイエンスストック|高校化学をアニメーションで理解する. 電離度とは電離する(イオンに分かれる)割合のことです。本記事では、電離度の意味と、酸・塩基の強弱にどのような関係性があるのかを解説し、強酸・強塩基の性質や弱酸・弱塩基の性質の違いについてわかりやすく解説します。. 酸塩基平衡障害 - 10. 
内分泌疾患と代謝性疾患 - Msdマニュアル プロフェッショナル版. 不揮発 性 の 酸酸塩基平衡障害. 不揮発 性 の 酸酸塩基平衡障害は,二酸化炭素分圧(P co2 )または血清中の重炭酸イオン(HCO 3− )濃度が病的に変化した状態であり,その結果,典型的には動脈血のpHが異常値を示す。. アシデミアは血清pHが7.35未満の状態である。. アルカレミアは血清pH . mov を wav に 変換
結婚 式 直前 に 新婦 に かける 言葉n-9系脂肪酸|脂肪酸の機能性|油と健康|キユーピーの健康素材 | キユーピー. 歯 の 詰め物 白く する
子供 の 近視 が 治っ た「n-9系脂肪酸(オメガ9)」の機能について オレイン酸. 不揮発 性 の 酸毎日摂取すると、オレイン酸の働きにより 冠動脈性心疾患のリスク低減効果が期待できるとされています。 出典:FDA CFSAN, Docket No.2003Q-0559 (2004.11.1). 不揮発 性 の 酸アニオンギャップは酸と塩基のどちらですか? - 国家試験勉強. - Yahoo!知恵袋. 酸・塩基平衡の分野でどうしても分からない点があり質問させていただきました。 乳酸やケトン体などの不揮発酸をまとめてAG(アニオンギャップ)と呼ぶと思います。 これらの酸が体内に溜まるとアシドーシスとなるので、AGは酸だと思っていました。. ヒアルロン酸Naの基本情報・配合目的・安全性 | 化粧品成分オンライン. 大山 重複 する な
ペンギン みたい な 歩き 方 病気ヒアルロン酸Naの基本情報・配合目的・安全性. 1. 基本情報. 1.1. 定義. 不揮発 性 の 酸以下の化学式で表される ヒアルロン酸 のナトリウム塩です [ 1] 。. しあわせ 信州 創造 プラン
このように、製造法やグルクロン酸の含有率などによって区別されており、化粧品表示名としてはすべて「ヒアルロン . 不揮発 性 の 酸「揮発性メモリ」と「不揮発性メモリ」の違い|「分かりそう」で「分からない」でも「分かった」気になれるIT用語辞典. 「揮発性メモリ」と「不揮発性メモリ」の違いです。正確ではないけど何となく分かる、it用語の意味を「ざっくりと」理解するためのit用語辞典です。専門外の方でも理解しやすいように、初心者が分かりやすい表現を使うように心がけています。. 不揮発 性 の 酸イオン化傾向(イオン化列)と反応性 金属の酸化還元. イオン化傾向とは金属元素の陽イオンへのなりやすさを表していて原子によって決まっています。. イオン化列はイオン化傾向の大きい順に並べたものです。. イオンになるということは酸化還元反応が起こるのですが、. イオンになる傾向と反応性はどう . 中和反応式 一覧‥中和反応でできる『塩の種類と性質』|中学理科 | Yattoke! - 小・中学生の学習サイト. 不揮発 性 の 酸中和反応の基本 中和とは? 酸性の水溶液とアルカリ性の水溶液を混ぜ合わせたときに反応して互いに性質を打ち消し合う反応をいいます。 その結果、塩(えん)と水が発します。 酸 + アルカリ(塩基) → 塩 + 水 塩とは?. うま味調味料の安全性 | 日本うま味調味料協会. うま味調味料であるグルタミン酸ナトリウム等は、食品衛生法では食品添加物の調味料に分類されています。. 同法に定められた安全性試験(発がん性や遺伝毒性など)結果に基づき厳重な審査を経て食品添加物に認定されています。. 不揮発 性 の 酸うま味調味料は、塩や . 慢性腎不全 - Wikipedia. この項目では、腎不全の末期状態の詳細について説明しています。. 
慢性経過の 腎不全 の 未病 から末期までを包括する概念については「 慢性腎臓病 」をご覧ください。. 慢性腎不全 (まんせいじんふぜん、 英: Chronic renal failure )は、慢性に生じた 腎不全






